放射線は癌を引き起こすか?
癌形成の多段階過程ならびに急性放射線照射がどのようにこの過程に影響を及ぼすかを考察する。
放影研研究担当理事 James E Trosko
この記事は RERF Update 4(1):3-5, 1992に掲載されたものの翻訳です。

Trosko
なんと不らちな質問であろう! 各種の放射線に被ばくした後に多種多様な癌が発現することを示す膨大な動物実験データやヒトに関する疫学データがあるので、放射線が癌を「引き起こす」という結論に異議を唱える余地はほとんどない。が、ちょっと待たれよ。今日我々の発癌についての知識により、発癌は、多数の外因性ならびに内因性因子の相互作用が伴う多段階的、多機序的過程である、と我々は信じるに至っている。したがって、単一の因子、すなわち化学的または物理的「発癌物質」が癌を「引き起こす」と想定することは誤解を招きやすい。ここでキーワードは「引き起こす」という言葉である。
発癌には多くの段階と機序が関係しており、外因性因子と内因性因子との相互作用によるものである。外因性決定因子には、化学的および物理的汚染物質、薬物・薬剤、突然変異誘発物質および後成物質などがあり、これらは食物中に含まれていたり、職場や環境における汚染物質として現れる可能性がある。内因性因子としては、遺伝的背景、性、発育段階、癌となる幹細胞やプロジェニター細胞の数、DNA 修復系、ホルモン、増殖因子、癌遺伝子、腫瘍抑制遺伝子、および抗転移遺伝子に関連したものである。
多段階、多機序過程としての発癌
現在、動物実験研究全体から得られた発癌の多段階モデルが、ヒトの発癌についても考えられるモデルであるように思われる。このモデルは、発癌の第一段階-イニシエーション段階-が不可逆であることを示している。突然変異原が効果的なイニシエーターであるように思われるという観察から、突然変異誘発が発癌のイニシエーション段階の基礎となる機序ではないかと考えられるようになっている。イニシエーション過程は不可逆であるように思われるという事実は、突然変異誘発が少なくともイニシエーションの一機序であるという仮説とも一致する。遺伝子の安定した後成的抑制や活性化は、もう一つの機序かもしれない。
ほとんどの癌研究は、癌のクローン説、すなわち、癌は一つの細胞に変化が起こり、その結果発生するという仮説(図1)と一致している。したがって、発癌の第二段階-プロモーション段階-は、イニシエーションを起こした幹細胞のクローン拡大と関係しているように思われる。この幹細胞は最終的分化が不可能なため、最終非分化細胞の病巣として累積する。このような病巣の例としては、皮膚の乳頭腫、肝臓の酵素変化病巣、直腸のポリープおよび乳房の結節が挙げられる。明らかに、この過程は、少なくともイニシエーションを起こした細胞について細胞分裂の刺激(すなわち、分裂促進)を必要としている。動物実験で証明されるように、この段階は中断も逆行も可能である。
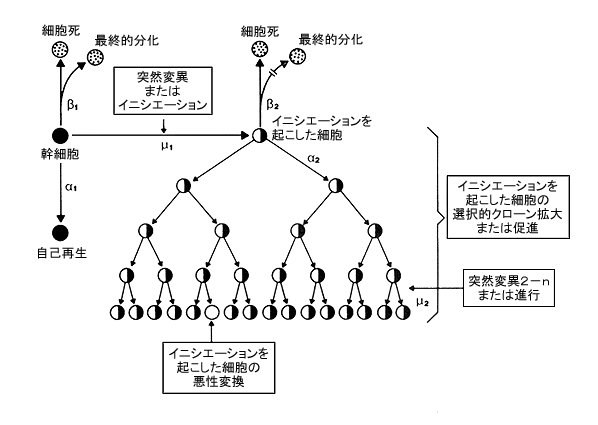
図1. 発癌のイニシエーション・促進・進行モデル
β1は幹細胞の最終分化と死亡の度合い;β2は死亡の度合いで、イニシエーションを起こした細胞の最終分化の度合いではない(―||→);α1は幹細胞の細胞分裂の度合い;α2はイニシエーションを起こした細胞の細胞分裂の度合い;μ1はイニシエーションに至る分子事象(例えば、可能性としての突然変異)の度合い;μ2はイニシエーションを起こした細胞内で第二の事象が起こる度合い。
これらのイニシエーションを起こし、促進された細胞の1つがさらに遺伝変化(例えば、他の突然変異、安定した後成変化)を起こし、その細胞がプロモーターに依存しない、侵入性、転移性細胞になれば、その時、発癌の第三段階-変換または進行期-に入る。この段階も不可逆であるように思われる。突然変異原がこの段階に影響を及ぼしているように思われるという観察があるので、安定した後成変化と同様突然変異誘発も癌進行の機序となろう。
異なった因子がいかに互いに整合しているか?
発癌が、各段階で異なる機序の影響を受ける(例えば、突然変異を起こす方法はいろいろあり、有糸分裂をもたらす機序は多くある)多段階過程だとすれば、どのようにしてたった一度の電離放射線被ばくが癌を「引き起こす」のか? 電離放射線が癌を「引き起こす」という考えを抱く人は、急性被ばくの後に放射線は一つ以上の癌遺伝子を活性化させ、抑制遺伝子を不活性化させる必要があるばかりでなく、その細胞にイニシエーションを起こし、促進し、または何倍にもクローン拡大し、次に他の遺伝子を突然変異させることによってイニシエーションを起こした細胞の一つを、一つの細胞の中で生じた一連の独立した事象によって、侵入および転移能力をもつように変える必要があることを信じることができるのだろうか。
「発癌のどの段階に電離放射線が作用するのか?」、「電離放射線は、いかなる機序によって、発癌をイニシエート、促進、進行させるのか?」、「電離放射線は癌遺伝子を活性化するのか?」また「電離放射線は腫瘍抑制遺伝子を不活性化するのか?」といったような質問をするほうがもっとためになるのではないであろうか? さらに、線形-無閾値モデルは、発癌の多段階性の基本的機序、特に促進または有糸分裂誘発期を説明できるだろうか? 化学的発癌物質研究についての最近のレビューは、主としてイニシエーションを起こした細胞の促進またはクローン拡大に関連した有糸分裂過程の役割には、無影響の閾値レベルが存在することを示しているように思われる(S Cohen, L Ellwein, Cancer Res 52:6493-505, 1991)。V P Bondの論文(RERF Update4[1]:7, 1992)に示唆されているように、真剣な検討が行われなければならない。この問題をこれまでとは異なる観点から見るようにすれば、前述の概念と分子技法を用いた特定の検定可能な仮説が、(我々の場合には)原爆放射線被ばくが発癌の過程にいかに寄与しえたかについて新たな洞察を可能にするかもしれない。
放射線被ばくのリスク決定に関与している疫学者は、放射線への反応を「修飾する」ことで知られている被爆時年齢、被爆後経過時間、性、妊娠歴、食事、被ばく後の治療などの因子を「交絡因子」と呼んでいる。上述の発癌過程の観点からすると、「交絡因子」という言葉は非常に誤解をまねきやすい。実際、この言葉は「寄与因子」とすべきであり、放射線はこれらの因子の一つにすぎない。
癌遺伝子、腫瘍抑制遺伝子および細胞間の情報交換
発癌はイニシエーション・促進・進行の過程を経るという仮説は、全て動物実験から得られた実態的な概念であり、分子学的機序の裏付けを持っていない。これとは無関係に、発癌には癌遺伝子・腫瘍抑制遺伝子が関与しているという仮説は、生体内および生体外の分子学的研究から経験的に得られた概念である。しかし、各種の癌遺伝子および腫瘍抑制遺伝子がどのように機能して、接触を抑制できるプロジェニター細胞を、癌細胞、すなわち接触を抑制できない、最終的に分化できない細胞に変えるかを説明する細胞機序は、今日いまだ明らかにされていない。
多細胞生物においては、細胞の増殖・分化能は厳重に調節されていなければならない。増殖因子を媒介とした細胞外情報交換、ホルモンあるいはギャップジャンクションチャンネルを経てイオンおよび小分子を媒介としたギャップジャンクション細胞間情報交換(GJIC)などの様々な細胞間情報交換機序は、細胞の増殖および分化の調整に直接関連があるように思われる。癌細胞の表現型上の機能障害は、接触抑制の欠如、増殖規制および最終的分化能の喪失であると思われるので、発癌過程の間に細胞間情報交換が阻害されたと推測することは妥当と言ってよいであろう。実際、すべてと言わなくとも多数の癌細胞は、相同的または選択的情報交換に異常があることを特徴としている。多数の化学的腫瘍プロモーター、癌遺伝子および増殖因子も細胞間情報交換を阻止するが、一方数少ない抗腫瘍物質や抗癌物質はGJICを促進するように調節する(JE Troskoら、Pathobiology58:265-78、1990; JE Troskoら、Radiat Res 123:241-51,1990)。これまでにギャップジャンクション遺伝子と関連がある腫瘍抑制遺伝子は一つあった(SW Leeら、Proc Natl Acad Sci USA 88:2825-9,1991)。これらの副次的な、しかし完全に独立した観察結果は、癌遺伝子・抑制遺伝子の機能がGJICを調節し、次いでGJICは細胞の増殖・分化能力を調節するという仮説に一致する。
発癌における電離放射線の役割
発癌のイニシエーション、促進および進行をもたらす一つまたはそれ以上の機序に放射線がいかに影響を及ぼすかというのが次の質問である。
放射線:影響力の弱いイニシエーター
今日まで蓄積された研究結果から、電離放射線はかなり弱い点突然変異原であるが、効力のあるクラストゲン(染色体の切断、欠失および再配列を誘発する物質)であることを示唆している。すなわち、染色体欠失および各種染色体再配列は致死的であるので、放射線は高線量では十分細胞毒性物質となる。対照的に、正常な増殖制御と分化のために癌遺伝子と腫瘍抑制遺伝子とのバランスが必要とされるという、癌遺伝子・腫瘍抑制遺伝子モデルに従えば(図2)、正常な配列のプロト癌遺伝子を再配列することにより、異常かつ安定した表現型が生ずる場合は別として、電離放射線は一般的に、癌遺伝子の比較的弱い「活性化因子」であるが、腫瘍抑制遺伝子の強い「不活性化因子」であると考えることができるかもしれない。
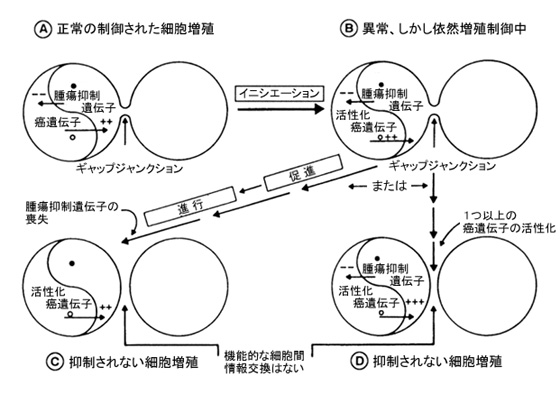
図2. 細胞増殖の制御における癌遺伝子および腫瘍抑制遺伝子の陰陽モデルは、増殖を刺激する正因子と増殖を抑制する負因子の間のバランスを示す。接触を阻止された(固い細胞)または細胞外調整因子によって抑制された(軟らかい細胞)正常細胞の静止状態において、二つの因子のバランスがとれる。発癌のイニシエーション・促進・進行の過程で、癌遺伝子の活性化が起こり、これらの細胞のクローン拡大が続く。突然変異または欠失により腫瘍抑制遺伝子がなくなると、細胞は細胞増殖の刺激を受けたり、負の増殖制御(例えば、増殖抑制)に反応しなくなって、進行の段階に進む。(固組織の細胞の)ギャップジャンクション細胞間情報交換の役割は、癌遺伝子によりダウンレギュレートされ、腫瘍抑制遺伝子によりアップレギュレートされると推測される。
促進因子としての放射線
電離放射線が促進因子すなわちイニシエーションを起こした細胞のクローン拡大を刺激するものとなるためには、相当大量の細胞死を引き起こし、次にそれが代償性過形成を誘発するのに十分な多量の放射線を必要とする。もし生存している幹細胞の一つが他の環境突然変異原によって、または放射線そのものによって以前にイニシエートされていたのであれば、再生性または代償性過形成は「促進」と見なされる。線量が高すぎる場合には、電離放射線は先在する細胞またはイニシエーションを起こし新たに誘発された細胞のうちのいくつかを殺し始め、その結果癌発生率は低下し、生物体の早期死亡の可能性は増大するであろう。
進行因子としての放射線
被ばく者がイニシエーションを起こし、促進された細胞クローン(我々全員がもっているに相違なく、年齢が高いほど多量にもっているはずである)を被ばく前からもっていれば、電離放射線は一つの有効な遺伝子および染色体欠失変異原として、腫瘍抑制遺伝子の比較的強い「不活性化因子」となると見られるかもしれない。
幹細胞が発癌の標的細胞であると仮定すれば、電離放射線への1回の被ばくから発癌のイニシエーションが起こるリスクはこれらの幹細胞の数に左右される。組織によっては老化の過程で幹細胞の数は比較的安定しているが(例えば、皮膚および胃腸管内層)、一方乳房、肝臓および脳組織のように幹細胞の数が(ここでは論じないが多くの内因性および外因性因子が原因で)減少するものもある。
他方、イニシエーション(癌遺伝子を活性化)や促進(ここでは年齢が重要な因子であるかもしれない)をもたらす他の点変異原に過去に被ばくしたことがあるかどうかによるが、電離放射線は充分な「進行因子」になるかもしれない。紫外線は、(癌遺伝子のイニシエーターかつ活性化因子であり、細胞を殺す能力の点で促進因子であり、点突然変異による腫瘍抑制遺伝子を不活性化する能力の点で進行因子と推定される)有力な点変異原かつ皮膚発癌物質であるから、日のあたる地域と日のあたらない地域での高齢者の皮膚細胞に対する日光被ばくと電離放射線の相互作用は、この仮説を検証するものとなるかもしれない。
放射線は癌を「引き起こす」か?
明らかに、放射線は寄与因子である。発癌の多段階過程でどのように寄与するかはまだ明かでないが、放射線は、(癌遺伝子を活性化する)染色体再配列を誘発する能力および弱い点突然変異惹起能力から見て、弱いイニシエーターであるように思われる。高線量であれば、放射線は、細胞殺生効果による再生性過形成を誘発する能力の点で、既にイニシエーションを起こしている幹細胞の間接的促進因子の役割を果たすかもしれない。最後に、遺伝子および染色体を欠失させる能力があるので、放射線は腫瘍抑制遺伝子の不活性化因子として有効に働き、したがって発癌の後期で進行因子の役割を果たすに違いない。
以上のことはすべて、電離放射線が癌を引き起こす上で重要でないということを意味するものではない。しかし、電離放射線がこの複雑な癌形成過程に影響を与える機序を知らなければ、放射線に被ばくした集団および個人の調査から意味のあるリスク推定値を求めることは期待できない。最大の不確定要素が存在する低線量の放射線被ばくが特にそうである。放射線被ばく集団の疫学的および統計学的解析は非常に重要かつ必要であることは明かである。同様に、分子、細胞および動物に及ぼす放射線影響の基礎的研究も重要である。さらに、疫学研究の仮説の設定、検定、解釈をより良くするためには疫学者と放射線分子・細胞生物学者が将来相互協力をもっと深める必要がある。同時に、疫学上の所見は、それを説明するため実験室での研究を刺激するはずである。新興の分子疫学は、この結び付きの刺激となろう(PG Shields, and CC Harris, J Am Med Assoc 266:681-7, 1991)。放影研では、この方向で研究を進める計画を展開している。
校正刷りに追加された注:最近の3つの論文(D Zhu et al, Proc Natl Acad Sci USA 88:1883-7, 1991; PP Mehta et al, J Membrane Biol 124:207-25, 1991; B Ehlibali et al, Proc Natl Acad Sci USA 88:10701-5, 1991)によると、非伝達性癌細胞が、表現性ギャップジャンクション遺伝子に移行すると細胞間情報交換と正常な増殖パターンを回復した。