末端標識したゲノムDNA断片の2次元電気泳動法
生殖細胞突然変異の有無を調べるため、2000個以上のDNA断片をスポットとして同時に検出できる非常に効率の良い方法を述べる。
放影研遺伝学部遺伝生化学研究室 浅川順一
この記事は RERF Update 7(1):3-5, 1995に掲載されたものの翻訳です。
我々研究グループは、ヒトの生殖細胞における自然発生および電離放射線誘発の突然変異を研究することに主に焦点を当てている。従来の方法よりも効率的かつ効果的な方法を絶えず探求してきた。3年前(1991年に)、第14回日本分子生物学会において、国立循環器病センター研究所の畑田らが発表した興味深い方法を知った。この、プローブをまったく用いず、1試料のゲノムDNA消化物から 2000個余りのDNA断片をスポットとして検出することができる 新2次元電気泳動(2-DE)法が、非常に強く印象に残った。畑田らはこの方法を 制限酵素標識ゲノムスキャン法 と呼んでいるが、遺伝子の欠失、増幅などのゲノムの変異を解析するのに有益である。この目的で、この 2次元電気泳動法 を 突然変異スクリーニング法 として改良し、我々の研究に利用できないか探求してきた。変異の複雑なパターンを解析するため、ミシガン大学でJames V. NeelとSamir M. Hanashのグループが蛋白質2次元電気泳動ゲル用に開発したコンピュータアルゴリズムを我々は用いている。コンピュータ解析は、コンピュータ科学者 Rork Kuick により行われた。この記事では、2次元電気泳動薄層ゲルのオートラジオグラフィーを行い視覚化したDNAスポットのヒトにおける定性的および定量的変異を検出する取り組みの現状を述べる。
2次元電気泳動法の基本的手順
ゲノムDNAを制限酵素NotIとEcoRVで消化する(図1.参照)。NotIによりできる突出末端をT7ポリメラーゼにより32P標識のデオキシヌクレオチドで満たす(図1.に青で示してある)。この特定のNotI切断部位のアイソトープ標識が2次元電気泳動法の重要な特徴であり、NotI切断部位を一端もしくは両端に有するDNA断片が視覚化される。 NotI切断部位は均一には分布しておらず、遺伝子の5
 側によく見られるメチル化していない「CpGアイランド」に高頻度で分布する。したがって、NotIを制限標識酵素として利用すると、恐らく視覚化した断片の多くは活性のある遺伝子に由来すると思われる。現在の1次元目の電気泳動法の開発には相当な実験が行われた。放影研遺伝生化学プログラムでは蛋白質変異体を研究するために、ディスクゲル電気泳動システムを多用してきており、このシステムをDNA用ゲルに適用した。実験を幾度も繰り返した後、内径2.4mm、長さ60cmのテフロンチューブ内にアガロースゲルを作製すると最もよい結果が得られた。テフロンチューブの凹凸のある内面が電気泳動中のアガロースゲルの位置を安定化させることが分かった。DNA試料約1
側によく見られるメチル化していない「CpGアイランド」に高頻度で分布する。したがって、NotIを制限標識酵素として利用すると、恐らく視覚化した断片の多くは活性のある遺伝子に由来すると思われる。現在の1次元目の電気泳動法の開発には相当な実験が行われた。放影研遺伝生化学プログラムでは蛋白質変異体を研究するために、ディスクゲル電気泳動システムを多用してきており、このシステムをDNA用ゲルに適用した。実験を幾度も繰り返した後、内径2.4mm、長さ60cmのテフロンチューブ内にアガロースゲルを作製すると最もよい結果が得られた。テフロンチューブの凹凸のある内面が電気泳動中のアガロースゲルの位置を安定化させることが分かった。DNA試料約1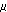 gを電気泳動した。約40時間電気泳動した後、長さ約1-5kbのDNA断片を含む32cm部分のディスクゲルをチューブから押し出し、制限酵素HinfIとインキュベートした。HinfIで消化されたDNA断片をポリアクリルアミド薄層ゲル(35 × 50cm)上でさらに垂直方向に分離した。ゲルを乾燥させ、オートラジオグラフィーを行う。
gを電気泳動した。約40時間電気泳動した後、長さ約1-5kbのDNA断片を含む32cm部分のディスクゲルをチューブから押し出し、制限酵素HinfIとインキュベートした。HinfIで消化されたDNA断片をポリアクリルアミド薄層ゲル(35 × 50cm)上でさらに垂直方向に分離した。ゲルを乾燥させ、オートラジオグラフィーを行う。
図1. DNA 2次元電気泳動改良法
分析したオートラジオグラムのデジタル画像を 図2. に示す。
我々の実験条件に従い作成したDNA2次元電気泳動用ゲル1枚で、約2000個のスポットが視覚化できる。ゲル上に現れるスポット強度は通常2つの相同なDNA断片のものと思われる。
原則として、このシステムは、1) 研究で用いられた3種類の制限酵素に対する切断部位の獲得または失うことによるもの、2) 挿入/欠失/再配列(I/D/R)によるもの、の2種類の遺伝的変異を検出する。前述の1)、2)のいずれかによって断片の長さに検出可能な差が生じた場合、2つの相同なDNA断片のうち1個だけが正常な位置にあり、このスポットのオートラジオグラフィー濃度は半分に減少するはずである。変異の生じた断片は、ゲル上の別の場所に移動するか(新しいスポット)、ゲルの中に入らない、あるいは、ゲルの外に出てしまうかのどちらかである。通常はゲル上に現れない断片で変異が起こり、その結果として新しいスポットが現れることもある。挿入/欠失/再配列により、二つの相同な断片のうち片方が除去される可能性もある。前述の1)、2)のいずれかに関して、変異体がホモ接合であれば、それに相当する正常なスポットが完全に消失するはずである。遺伝的分析を開始するには、これらの断片は位置的・量的に安定していなければならない。
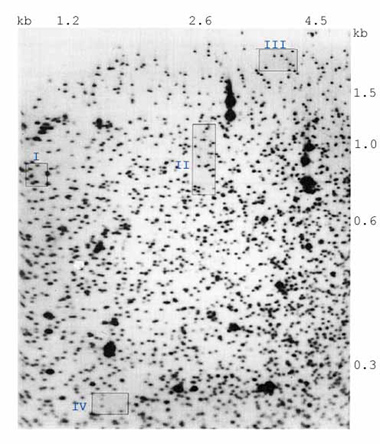
図2. 分析したオートラジオグラムの部分のデジタル画像
各次元の断片の大きさを示してある。発表されているDNA配列に基づくと、濃いスポットのほとんどの位置が、リボゾームDNA断片またはEpstein-Barrウィルス断片の予想される位置に一致する。ここで番号を付けた青い枠で囲んだ変異体は、図3. の4個のパネルに相当する。
この画像にある 約2000個のスポットの定量性を調べるため、はっきりと分離しており、ゲルの縁近くでなく、また画像上の大きなスポットの1つではないスポットを 774個 候補として選んだ。この分析は父母子の3人を1組とする家族 3組に限定し、2度別々の機会に電気泳動した。予備的な分析では、774個のスポットのうち、64個が「特別」であるとして選ばれた(スポットは遺伝的多型に属すると判断された)。必要とされる精度をもって、2個の相同なDNA断片に由来するスポットを1個の断片のみに由来するスポットと識別するには、スポット量の変動係数は 0.12以下 でなければならない。現在、我々のゲルの中で 439個のスポットがこれらの基準を満たしている。2コピーの相同なDNA断片のスポット量と、同一のDNA断片 1コピー分のオートラジオグラフィー濃度を識別できる現在の能力に特に注意が向けられるであろう。これは、突然変異は通常、両親は共に正常のスポット量を有するとき、その子供に正常の半分のスポット量として現れるからである。子供に見られるこのスポット量の減少に伴いゲル上に新しいスポットが現れる場合もあるし、現れない場合もある(浅川ら、Proceedings of National Academy of Science, USA 91:9052-6, 1994)。
定性的変異(定量性にはとらわれずにスポットが有るか無いか)の研究では、定量的研究の基礎である774個のスポットを含むすべてのオートラジオグラフを調べた。この研究では定量的研究に用いた 3人1組(トリオ)の家族3組のほかに、さらに家族3組、合計6組のトリオを用いた。全体で、個人間で有ったり無かったりするような変異する断片が 392個検出された。断片が子供のパターンには有って、その子供の少なくとも片方の親に同じ断片が見られないという例は1例もなかった。これら392個のスポットのうち、184個はすべての対立遺伝子が検出されている85種の多型システムに分類できた。認められた85種の多型システムは、対立遺伝子を表すスポットの相対的な位置に基づいて4つのカテゴリーに分類することができる。これらのタイプそれぞれの多型の例を 図3. に示す。この図はまた、ヘテロ接合(各1コピーのスポット)とホモ接合(2コピーのスポット)の相対スポット量の違いは容易に検出できることを示している。
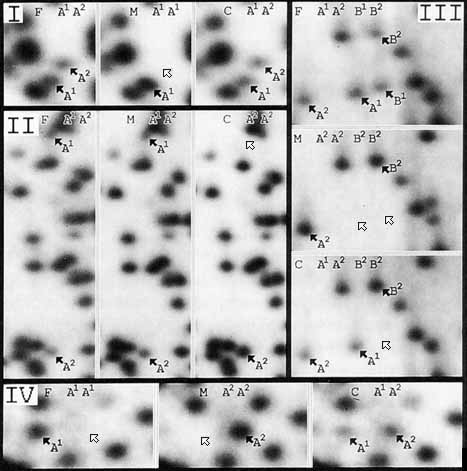
図3. 観察される多型の種類
I-IVのパネルはそれぞれ家族1人1組の2次元DNAゲルの一部を示す。F:父、M:母、C:子とした。矢印は変異スポットを示す。黒い矢印はパターンの中に存在するスポットを示し、白い矢印は欠失しているスポットを示す。各人の推定される遺伝子型を示す。
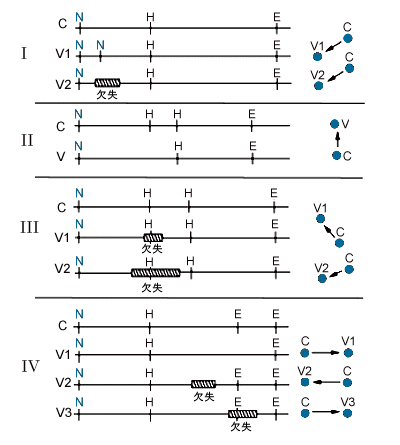
図4. スポットの対立遺伝子対の様々な位置的構成を説明しうる制限酵素地図
パネルⅠ-Ⅳは 図3. のパネルに相当する。Cと分類した断片は普通の対立遺伝子で、V1、V2、V3は変異体を表す。制限酵素認識部位はN:NotI、H:HinfI、E:EcoRVで示す。
図4. は、それぞれのタイプの多型についての、ゲル上で互いに相対する対立遺伝子断片の位置を説明するDNA変異の模式図である。この研究の対象となった6人の父親と1人の男の子供には、必ずさらに2つの断片が見られたが、5人の女の子供と6人の母親のパターンにはなかった。さらに、これらのスポットの量はパターンの中のその他のスポット量の約半分だったので、これらの断片はY染色体からのものであるという可能性がある。残り206個の変異断片は、対立遺伝子断片すべてが識別されているわけではない多型システムに属していた。これらのスポットの多くが、対立遺伝子がゲルの分離サイズ範囲外の断片を生じさせる多型システムの、もう一方の対立遺伝子を表しているかもしれない。あるいはこれらのスポットの幾つかは一つの多型性の対立遺伝子として互いに関係し合っているかもしれないが、対立遺伝子断片間の移動位置が大きく違うため、その関係は確立されていない。
2次元電気泳動DNA分離システムにより、著しく再現性の良い2次元電気泳動パターンが得られた。多くの標識非変異スポットがパターン全体に存在し視覚による検索を可能にしており、自動スポットマッチングを容易にし、変異スポットのサイズ基準となっている。父母子3人を1組とする家族6組の2次元電気泳動パターン解析により、かなりの数のスポットに見られる位置的・量的変異は遺伝的なものであることが明らかになった。一度に約2000個の断片を視覚化でき、1次元目、2次元目のどちらの分離次元の変異も検出できるので、従来の 1次元電気泳動法 によるゲノムDNA断片の分離と比較して、得られる情報量が明らかに増加している。これら 2000個のスポットは1-5kbの小さいNotI-EcoRV断片から得られる。我々は現在、新しい 2000個のスポットを視覚化する、1-5kbに連続する5-20 kbとより大きいNotI-EcoRV断片を解析するための2次元電気泳動パターンを開発中である。構造変異体または突然変異体の特性を調べられる技術の開発により、この方法のパワーは高くなるだろう。そのようなゲノムDNAライブラリーの開発、DNAスポットの標的クローニング、2次元電気泳動DNAゲルのサザンブロッティングなどの技術開発を含む研究は、放影研の小平美江子研究員と共同で実施している。