放影研遺伝生化学調査の進展
次世代に遺伝するタイプの突然変異を、原爆被爆者の子供に検出しようとする現行の調査では、多種類の突然変異を探すために多数のヌクレオチドの検査が必要である。
放影研遺伝学部 佐藤千代子、小平美江子
この記事は RERF Update 6(3):3-4, 1994を引用改訂したもので、最新のデータは文献 Satoh C, Takahashi N, Asakawa J, Kodaira M, Kuick R, Hanash SM, Neel JV: Genetic analysis of children of atomic bomb survivors. Environmental Health Perspectives 104(Suppl 3):511-9, 1996に発表された。
原爆被爆者の子供への遺伝的影響の可能性をDNA/RNAレベルで調査するために、放影研遺伝生化学研究室では、将来のスクリーニング・プロジェクトで使用するために、技法を開発し、細胞株を樹立している。
細胞株の樹立と保存
我々の目標は、Epstein-Barrウィルスによる形質転換を利用して、1000家族のBリンパ球から細胞株を樹立することである。突然変異調査では子供の両親の検査が必要であること、被爆後50年近く経過した現在では、多くの被爆二世の親(すなわち被爆者)が死亡または転出により検査できなくなっていることから、(将来に備えて)細胞株の樹立が必要と考えられた。これらの家族のうち500家族では、片親または両親が原爆放射線に被ばくしており、親の合計線量は0.01 Sv以上である。これらの家族の親の平均合計線量は0.5 Svである。残り500家族は対照群である。各家族は母、父、そして検査可能なすべての子供から成っている。
細胞株が樹立されると、様々な解析を行うに足る量のDNAが抽出できるだけの細胞数、すなわち5×108から1×109個までに増殖させた後、液体窒素中に保存している。スクリーニングで検出された突然変異が細胞株樹立の際に起きたものか否かを決定するために、無処理のリンパ球および顆粒球の一部も比較試料として液体窒素中に保存している。
現在までのところ、広島では500家族以上、プロジェクトを1年後に開始した長崎では440家族以上について、細胞株を樹立した。対象者は1965年改訂暫定線量推定方式を基に選択したので、1986年線量推定方式(DS86)による線量推定値がない親もいる。従って、親のDS86線量が推定されている家族を新たに追加する計画である。
DNA標的の決定
1991年のRERF Update 3(4):1に報告されているとおり、1991年11月に広島で開催されたヒト生殖細胞突然変異ワークショップにおいて、生殖細胞突然変異検出のための標的として、様々なDNAを比較するための試行調査が勧告された。
細胞株樹立が予定されている1000家族の一部である100家族の検査を、1992年半ばに開始した。以下の3つの技法を用いて様々な遺伝子またはDNA配列を検査している:
(1) 2-3キロ塩基対(kb)のDNAまたはRNA断片における単一ヌクレオチド置換および小さな欠失および挿入を検出するための、ポリメラーゼ連鎖反応(PCR)産物の変性剤濃度勾配ゲル電気泳動法、
(2) 単一配列における挿入/欠失/再配列(I/D/R)によるかなり長い配列差を検出するための、およびミニサテライトまたは、縦列反復数に差のある配列(VNTR)中の反復数の変化を検出するためのサザンブロッティング、
(3) マイクロサテライトにおける反復単位数の差を検出するためのPCR増幅マイクロサテライトの高解像度電気泳動法。
本記事ではミニサテライトおよびマイクロサテライトに関する検査について報告する。
ミニサテライトおよびマイクロサテライト検査
ミニサテライト または VNTRはヒトのゲノム中に分散しているが、染色体末端部に多く分布する傾向を示す。これらは短い配列単位(長さ5-40塩基対 [bp])が縦列に反復して、約1-20 kbの配列を形成したものであり、反復単位数の異なる多くの対立遺伝子がある。ヘテロ接合性の高い(表現型の中でヘテロ接合型の割合の高い)幾つかのミニサテライトでは、新しい長さの対立遺伝子を生じるような生殖細胞突然変異が高頻度で観察されている。子供64人を含む被爆50家族と、子供60人を含む対照50家族について6種類のミニサテライト遺伝子座を検査した。被爆家族の子供64人のうち、両親とも被ばくしていたのは1人だけであった。従って、100家族の子供124人を検査することにより、被ばくした親に由来する配偶子(精子および卵母細胞)65個および非被ばくの親に由来する配偶子183個(被爆家族の非被ばくの親に由来する配偶子63個および対照群の親に由来する120個)が検査できた。配偶子65個の親の平均生殖腺線量は1.9 Svであった。
細胞株から抽出したDNA試料を、ミニサテライトの縦列反復配列内を切断しないという性質を持つHinfI制限酵素で消化した後、通常のアガロース・ゲル電気泳動を行った。アガロース・ゲルから作ったサザン・フィルターを、6種のミニサテライト・プローブを用いて、順次ハイブリッド形成反応により分析した。子供のバンドを親のバンドと比較し、両親に同じ長さのバンドがない場合には、そのバンドを突然変異バンドと考えた。突然変異体を検出した場合は、反復配列の外側の、かつHinfI消化部位とは異なる位置でDNAを切断する第二の制限酵素AluIを用いて消化した後、これらの家族を検査した。CEB-1プローブにより検出した突然変異の例を図に示す。 HinfI消化物において息子のバンドの移動度が父親のバンドに比べて 約2kb減少しているが、AluI消化物でもバンドの長さは同じだけ減少している。このことは、突然変異がミニサテライト内の反復単位数の減少にかかわるという考えに一致する。突然変異が細胞株樹立の際に起こった可能性を除外するために、突然変異を検出した家族について、形質転換していないリンパ球から得たDNAを検査した。これらDNA中に検出されたすべての突然変異バンドは子供の細胞株DNAに観察されたものと一致しており、突然変異が親の生殖細胞に起きたことが確認された。
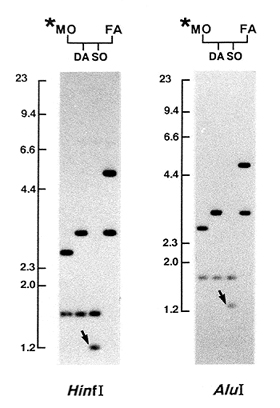
図. 家族0716の子供に検出された CEB-1遺伝子座における新しい長さの突然変異
矢印は各々HinfIおよびAluIの消化物における突然変異バンドを示す。息子(SO)のバンドの1つは母親(MO)のバンドの1つと同一であるが、残りの1つは父親(FA)のバンドのいずれにも一致しない。DAは娘である。星印は母親が原爆放射線に被ばくしたことを示す。DNAマーカーの位置および長さ(キロ塩基対単位)は写真の左に示す。
被ばくした親由来の65個の配偶子について、3種のミニサテライト遺伝子座(λMS1、CEB-1、pλg3)を検査したところ、6個の突然変異を検出した。残3種の遺伝子座では突然変異は検出されなかった。興味深いことに、183個の非被ばく配偶子において、同じ3種のミニサテライト遺伝子座で22個の突然変異を検出した。被ばくおよび非被ばく配偶子の平均突然変異率(突然変異/遺伝子座/配偶子)はおのおの、0.015 [6÷(65×6)]および0.02 [22÷(183×6)]であった。被ばくした親と非被ばくの親に由来する配偶子の6種のミニサテライト遺伝子座における平均突然変異率には統計的に有意な差は認められなかった。さらに、突然変異を検出した3種のミニサテライト遺伝子座の各々について、被ばくと非被ばくの配偶子の突然変異率の間に有意差はなかった。
被ばくと非被ばくの生殖細胞の突然変異率の間に有意差を示すのに必要な生殖細胞の検査数を推定した。自然突然変異率が、我々の調査で検査した 6種の遺伝子座の平均突然変異率と同じ 0.02の遺伝子座の場合、被ばく、非被ばくという2群の生殖細胞を、おのおの 1188個ずつ検査する必要がある(小平ら、American Journal of Human Genetics 57:1275-83, 1995)。これは 被爆50家族の子供 64人おのおのについて 19個 の遺伝子座を検査する必要を意味している。すなわち0.02/配偶子/遺伝子座の突然変異率を持つ 13個 の遺伝子座の追加が必要である。これは実際的な数と考える。我々は現在、追加スクリーニング用に、自然突然変異率が 0.02より大きい新しいミニサテライト遺伝子座を探している。変異率の高いミニサテライト遺伝子座を同時に多数検出し、DNAフィンガープリンティングにも用いられている多座位検出用ミニサテライト・プローブが、我々の目的にはふさわしいかもしれない。
マイクロサテライトでは 2bpから 6 bpの反復単位が、約10 – 50個繰り返している。マイクロサテライトは反復単位数に関し極めて多型であり、ヒトDNA中にかたよりなく高頻度で存在する。最近では、エクソン中のトリヌクレオチド反復数の異常増大は、脆弱X症候群、筋緊張性ジストロフィー症、脊髄延髄筋萎縮症(SBMA)、およびハンティントン病などの遺伝疾患を引き起こすことが判明しており、哺乳類における新しい形の突然変異発生と考えられる。脆弱X症候群の原因遺伝子FMR-1では、5′-非翻訳領域におけるCGG反復単位数は正常人でも多型であり、対立遺伝子群は 6-54個の反復数を示すが、罹患した患者は 200個以上の反復数を示す。さらに、白人家族の幾つかの遺伝子において、テトラヌクレオチド反復数の自然突然変異率が高い(約0.013 – 0.015)こと、遺伝性非ポリープ性大腸癌におけるマイクロサテライトの不安定性が報告されている。
我々は子供124人のFMR-1、AR(SBMAの原因遺伝子)、DM遺伝子のトリヌクレオチド反復数を検査した。この最初の2つの遺伝子は X染色体上にある。マイクロサテライトを含む配列をPCRにより増幅した後、塩基配列決定用ゲル上で電気泳動を行った。これらの子供のバンドを親のバンドと比較した。トリプレット反復配列を持つ子供の対立遺伝子で、被ばくした親に由来するもの 177個、および非被ばくの親に由来する対立遺伝子 443個を突然変異検出のためにスクリーニングした。これらの子供の対立遺伝子 620個からは突然変異は検出されなかった。我々は現在幾つかのテトラヌクレオチド反復配列を検査しており、これらのマイクロサテライトが適当な標的か否かをまもなく決定できる。
DNAの二次元ゲル電気泳動法
試行調査に導入する4つめの技法は、二次元ゲル電気泳動法(2-DE)として知られている。2-DEを用いると、各対象者のDNAを制限酵素で消化して得られる断片 約2000個が 1枚のゲル上で検出できる。この方法の利点は、プローブを必要とせず、制限酵素断片部位における塩基対置換および欠失挿入変異が検出できることである。これらの事象は通常は染色体2本のうちの1本で起き、残りの染色体は正常であるので、変異がある人のDNA断片スポットは、変異のない人のスポットの50%の濃度で、正常位置に検出される。欠失、挿入、塩基対置換の生じたDNA断片のスポットは、消失するか、濃度増大するか、他の位置へ移動する。従って、変異対立遺伝子と正常対立遺伝子からなるヘテロ接合体に起きたこれらの事象を検出するには、正確な定量化-すなわちスポット濃度の50%減少または増加を検出する能力-が必要である。泳動ゲルの再現性が向上したので、単一のDNA試料に由来する電気泳動パターンすなわちスポットの分布パターンを重ねあわせることができるようになった。
母/父/子のトリオから得たDNA試料の二次元ゲル電気泳動は我々の研究室で 浅川順一研究員が実施しており、オートラジオグラムはミシガン大学医学部でコンピュータ画像解析機を用いて解析した。同大学では、SM Hanash および James V Neel のために開発されたソフトウェアが、スポット濃度の定量化に有効であることが既に実証されている。
RERF Update次号(7[1]:3-5, 1995)で2-DE解析について報告したい。