ヒト放射線生物学のモデルとしてのSCID-huマウス
システムが欠損しているマウスへのヒト組織の移植は、in vivoの放射線リスクを評価するための得がたい機会を提供する。
放影研放射線生物学部 京泉誠之、秋山實利
この記事は RERF Update 4(2):3-4, 1992に掲載されたものの翻訳です。
ヒトの放射線生物学の研究は適切な in vivo の実験モデルがないことが大きな障害であった。もっとも、ヒトにおける急性・慢性の放射線影響は、原爆被爆者および治療目的もしくは事故によって被ばくした患者の調査で詳細に報告されてきた。しかし、これらの調査から得られた情報には、正確な放射線量の推定、および放射線誘発の病理形成を直接解析するための生物材料を入手することが困難なために限界があった。 In vitroでは、ある条件下で、皮膚線維芽細胞、Tリンパ球、および 骨髄CFU-C(colony forming unit-culture)等のヒトコロニー形成細胞の、単純な生存率データを解析することが可能である。しかし、このような in vitro の条件が、生体内に存在する複雑な微小環境条件を十分に反映するものかどうかについてはさだかではない。このような制限のもとで、意味のあるリスク評価を行うことは難しい。これらの点から、重症複合型免疫不全マウス-ヒト(SCID-hu)キメラをヒト放射線生物学用の in vivo 実験モデルとして使用することを提案する。
SCID-huマウスモデル
1988年に、SyStemix Inc.(カリフォルニア州Palo Alto)の J.M. McCune らが、胸腺、リンパ節を含めた機能性ヒト胎児血管リンパ管臓器の、重症複合型免疫不全(SCID)マウスへの移植に成功した(J.M. McCune et al, Science 241:1632-9, 1988)。最近になって、我々は機能性ヒト胎児骨髄のマウスへの移植の成功を報告した(S. Kyoizumi et al, Blood 79:1704-11, 1992)。 皮膚、肺、結腸など他のヒト組織もSCIDマウスに移植可能であり、移植後形態学的にも正常であることが分かった(R. Namikawa et al, 私信, SyStemix Inc., カリフォルニア州Palo Alto)。このようなキメラのマウス(SCID-huマウス)を、種々の電離放射線に実験的に被ばくさせて、ヒト組織に及ぼす放射線のin vivoでの影響を解析することができる。(図1.)
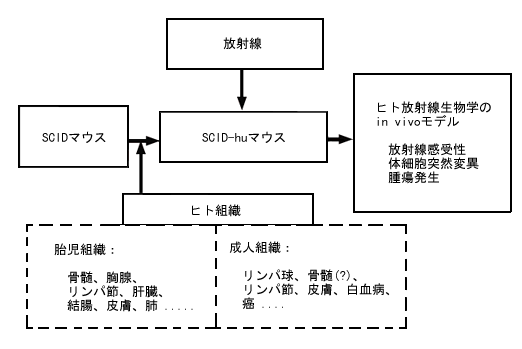
図1. SCID-huマウス系のヒト放射線生物学への応用
結果として、特定遺伝子突然変異および染色体異常などの放射線誘発性体細胞突然変異発生の in vivo 解析のみならず、ヒト組織の in vivo 放射線感受性の解析を行うことは現在可能であると思われる。また、適当なプロモーションによりこれらの放射線被ばくヒト組織におけるトランスフォーメーションあるいは腫瘍発生の研究も可能かもしれない。この実験系を用いて、放射線誘発性の発癌機構に関する多くの疑問(J.E.Trosko, RERF Update 4(1):3-5, 1992)に答えられると思われる。このようにして、SCID-huマウスモデルは原爆被爆者および事故により被ばくした人々に関する調査を補いサポートするデータを提供すると期待される。本モデルを使用した研究の結論は in vivo でのヒト組織の所見から直接得たものなので、in vitro や他のヒト以外の動物モデルから得られた知見よりも、ヒト放射線生物学により一層適切かつ有意義な知見を提供すると思われる。
ここでSCIDマウスに移植されたヒト骨髄における放射線の影響について簡単に総括する。また、本骨髄モデルを用いて原爆被爆者の造血幹細胞における体細胞突然変異を調査する可能性について考察する。
SCID-huマウスにおけるヒト造血への放射線影響
SCID-hu骨髄モデルはヒト胎児骨断片(18-20週齢)を SCIDマウスに外科的に移植することによって作成された(S. Kyoizumi et al, Blood, 79:1704-11, 1992)。骨断片移植には、造血幹細胞だけでなく造血に必要な微小環境がマウスに移入されるという利点がある。移植後、骨移植片中の造血活性は直ちに低下し、その後回復した。2-3週間後に実施された組織学的解析では、骨髄中の壊死性変化は見られたが、明らかな造血巣は確認されなかった。6-8週間後には、移植片の大部分が形態学的に正常なヒト骨髄に類似しているように見え、ヒトリンパ系、骨髄系、赤血球系および巨核球系の造成を伴う高いcellularityを示した。骨移植片の90%以上が20週間もの間、造血活性を呈し、これを維持していた。骨髄系前駆細胞(コロニー形成ユニット-顆粒球マクロファージ、CFU-GM)および赤芽球前駆細胞(バースト形成ユニット-赤芽球、BFU-E)を含むヒト前駆細胞活性がメチルセルロースコロニーアッセイで示された。フローサイトメトリー解析では、CFU-GMおよびBFU-Eコロニーから回収した細胞がそれぞれヒト細胞系特異的なマーカー、すなわち、CD15およびグリコフォリンAを発現することが示された。ヒト骨髄で通常見られる範囲内の一定レベルの前駆細胞活性が、20週間以上にわたり移植骨片中で維持された。これらの所見は、ヒト幹細胞を維持し、それらの分化を誘発するに適した微小環境がSCIDマウスにうまく導入されることを示すものである。
このSCID-huモデルを使って、in vivo のヒト造血に及ぼす放射線の影響に関する定量的データを得ることができる(S. Kyoizumi et al, Radiation Research, 137:76-83, 1994)。全身X線照射後、SCID-huマウスに移植されたヒト胎児骨髄は典型的な哺乳類の造血前駆細胞の放射線感受性を示した。CFU-GMおよびBFU-Eの生存曲線には肩となる部分が見られず、D0値はCFU-GMで1.0Gy、BFU-Eで0.7Gyであった。このCFU-GMのD0値はin vivoで放射線を照射されたマウスCFU-S(脾臓コロニー形成ユニット)およびCFU-GMのみならず、in vitro で照射されたヒト骨髄CFU-GMに見られたものと類似している(J.H. Hendry, International Journal of Radiation Biology 47:3-16, 1985)。マウスおよびイヌの骨髄についても赤芽球前駆細胞の放射線感受性が大きいことが報告されている。これらのデータは、ヒト造血前駆細胞の放射線生物学的特性が骨移植片中に維持されることを示唆している。また、このX線誘発急性造血障害は、照射前によく知られている放射線防護剤WR-2721(ラジカルスカベンジャー)を投与すると、有意に減少した。WR-2721 の線量減弱効果は正常なマウス骨髄に報告された値とよく似ている。さらに、低線量照射(X線照射 1.5Gy以下)後、骨髄移植片の造血機能は正常値に回復しうる。ヒト臨床試験における以前の報告では放射線被ばくによる骨髄機能抑制後に、ヒト顆粒球コロニー刺激因子(G-CSF)と顆粒球マクロファージコロニー刺激因子(GM-CSF)が、造血能力の回復を促進することが実証された(R.P. Gale, A. Butturini, Experimental Hematology 18:958-64, 1990)。我々は、SCID-huマウスにおけるヒトCFU-GM活性の回復がヒトG-CSFの投与により促進され、また好中球数が骨髄移植片内で顕著に増加することを示した。このように、ヒトG-CSFは放射線被ばく後生き残った骨髄系前駆細胞を刺激することにより、骨髄系の造血を促進したのである。
これらの調査によりSCID-huモデルが、ヒト放射線被ばくのリスク解析のみならず、ヒト造血系に及ぼす放射線障害を予防、治療するための新しい方法の開発にも適していることを立証しているかもしれない。
原爆被爆者の体細胞突然変異調査への適用
SCID-hu骨移植モデルはその他のヒト骨髄放射線生物学、とりわけ原爆被爆者の造血前駆細胞における放射線誘発突然変異の解析に用いられるかもしれない(図2.)。赤血球グリコフォリンA遺伝子の体細胞突然変異頻度の増加は、放射線被ばく後45年以上経過した後も、原爆被爆者に検出された(R. Langlois et al, Science 236:445-8, 1987; S. Kyoizumi et al, Cancer Research49:581-8, 1989; M. Akiyama et al, Journal of Radiation Research 32(Suppl): 278-82, 1991)。また、共通のHPRT遺伝子突然変異および染色体異常が、同じ被ばく者から分離された種々のT細胞、B細胞クローン中に検出された(M. Hakoda et al, Journal of Experimental Medicine 169:1265-76, 1989; Y. Kusunoki et al, Blood 86:2106-12, 1995)。これらの所見は、原爆被爆者において放射線誘発性突然変異が骨髄幹細胞に残されたこと、および突然変異幹細胞が突然変異成熟血液細胞を産出し続けたことを示唆している。本結論は成熟血液細胞の解析からの所見に基づいていることから、造血前駆細胞もしくは幹細胞中でこのような突然変異の直接的証明が強くもとめられている。
1つのアプローチは、放射線被ばく後に SCID-huマウス から分離された前駆細胞に誘発された、体細胞突然変異および染色体異常を解析することである(図2.)。
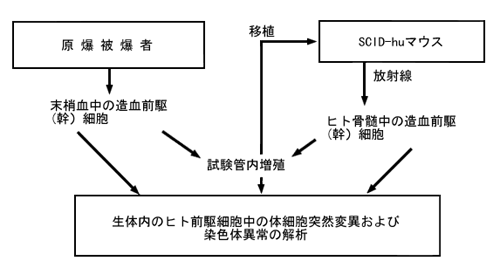
図2. 造血前駆細胞における放射線誘発体細胞突然変異調査の方法
もう1つは、原爆被爆者の末梢血から造血前駆細胞を直接分離する方法である。昨今の幹細胞技術の進歩によって、造血前駆細胞を精製し、これを stem cell factor を含むさまざまな造血因子存在下で培養し、増殖させることが可能になった(O.N. Witte, Cell 63:5-6, 1990)。原爆被爆者の調査にこの技法を用いれば、末梢血中に循環している造血前駆細胞中の体細胞突然変異を実証し、また直接に測定できるかもしれない。さらに、これらの突然変異造血前駆細胞をSCIDマウスに移植することができるかもしれない。また、SCIDマウス中でこれらの細胞は種々のヒト造血因子を投与された後、成熟血液細胞に分化するかもしれない。これら2つの方法により放射線被ばく後の突然変異幹細胞の生成・分化のダイナミックスを体系的に実証できるようになることが期待される。